25.11.2020
Тема: Физические и химические явления
Явления - изменения, которые происходят с веществами.
Физические явления - изменения, при которых не меняетя состав вещества.
Например, плавление металлов, испарение и конденсация воды, растворение соли в воде.
Химические явления (химические реакции) - изменения, при которых происходит превращение одних веществ в другие.
Например, горение бумаги, образование ржавчины на железе, разложение воды на водород и кислород.
Признаки химических реакций:
1. Образование нового вещества.
2. Выделение или поглощение тепла, света, запаха.
3. Изменение цвета.
4. Выделение газа.
5. Выпадение или растворение осадка.
Более подробно о физических и химических явлениях можно узнать посмотрев видео:
https://youtu.be/HPSGoI0f6UM
Домашнее задание: параграф 10, письменно: №2 ст. 62; №6 ст. 63.
Урок №13. 06.05.2020
Тема:
Значение воды в природе и жизни человека
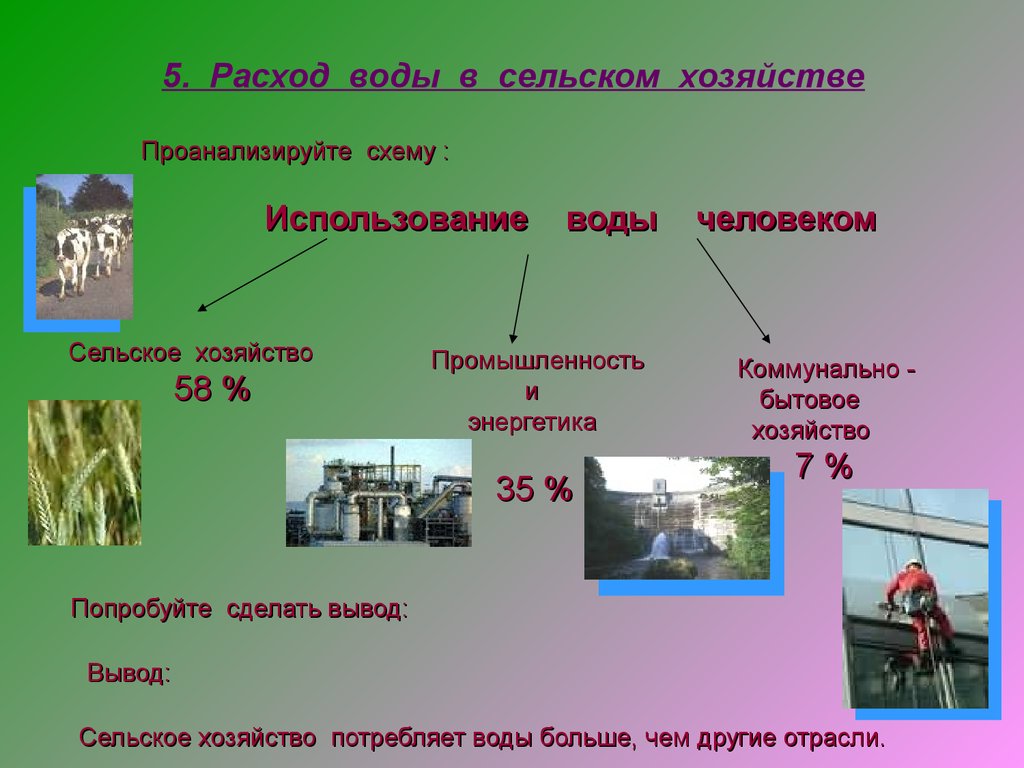
Вода - одно из важнейших веществ, без которого невозможно представить жизнь.

Также вода необходима в сельском хозяйстве и промышленности.
 Домашнее задание: параграф 22, приготовить презентацию, ментальную карту или схему на одну из тем:
1." Роль воды для живой природы"
2. " Роль воды в неживой природе"
3. "Использование воды в быту"
4. "Использование воды в промышленности"
5. "Использование воды в сельском хозяйстве"
6. "Проблема чистой воды и охрана водоемов от загрязнений".
Домашнее задание: параграф 22, приготовить презентацию, ментальную карту или схему на одну из тем:
1." Роль воды для живой природы"
2. " Роль воды в неживой природе"
3. "Использование воды в быту"
4. "Использование воды в промышленности"
5. "Использование воды в сельском хозяйстве"
6. "Проблема чистой воды и охрана водоемов от загрязнений".
Урок №14. 07.05.2020
Тема: Обобщение знаний по теме: "Вода".
Повторить вопросы по плану:
1. Что такое раствор? Компоненты раствора.
2. Задачи на вычисление массовой доли растворенного вещества.
3. Что такое индикаторы и как они действуют на растворы кислот и щелочей.
4. Гидраты оксидов - кислоты и основания. Каким оксидам какие вещества соответствуют.
По данным вопросам будет тест, код сброшу позже в гугл классе.
Урок №11 29.04.2020
Тема:
Взаимодействие воды с основными оксидами.
Напоминаю, оксиды - это сложные вещества состоящие из двух элементов, один из которых - оксиген. Оксиды делятся на основные - оксиды металлов (СаО, MgO, Fe2O3) и кислотные - оксиды неметаллов (Р2О5, СО2, N2O5).
При взаимодействии с водой основные оксиды образуют основания.
Основания - сложные вещества, состоящие из металлического элемента и гидроксильной группы ОН. Например, Са(ОН)2 - кальций гидроксид, Аl(OH)3 - алюминий гидроксид, Сu(OH)2 - купрум (II) гидроксид.
Группа ОН имеет валентность I. Сколько валентность металла, столько групп ОН в формуле основания. Чтобы дать название основанию, необходимо назвать металл, если он в побочной подгруппе в скобках указать валентность и добавить слово гидроксид.
Рассмотрим образование нескольких оснований:
СаО +Н2О = Са(ОН)2 - кальций гидроксид
FeO + H2O = Fe(OH)2 - феррум (II) гидроксид.
Тип реакции - реакция соединения.
Растворимые в воде основания называются щелочи.
Основания и кислоты изменяют цвет индикаторов:

Индикаторы - вещества, которые изменяют свою окраску в разной среде. В таблице 3 индикатора - лакмус - синий в растворе оснований, метилоранж - желтый и фенолфталеин - малиновый. Любым из этих индикаторов можно определить щелочную среду.
Рассмотрим лабораторный опыт на видео:
https://www.youtube.com/watch?v=YFzidUJBF-g
Домашнее задание: параграф 21, письменно: 1) составить формулы оснований: феррум (III) гидроксида, натрий гидроксида, магний гидроксида; 2) составить уравнения реакций образования этих оснований взаимодействием соответствующих оксидов с водой.
Урок №12. 30.04.2020
Тема:
Взаимодействие воды с кислотными оксидами
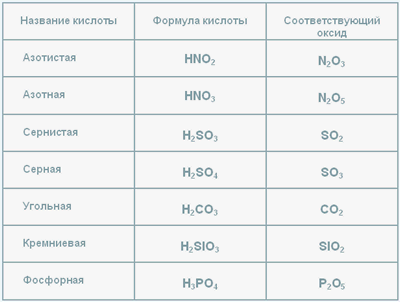
Кислоты это сложные вещества, состоящие из атомов гидрогена Н и кислотного остатка. Например, HNO2 - нитритная кислота, HNO3 - нитратная кислота, Н3РО4 - фосфорная кислота. Кислоты образуются в результате взаимодействия кислотных оксидов с водой.
SO2 + H2O = H2SO3 - сульфидная кислота
SO3 + H2O = H2SO4 - сульфатная кислота
Реакции соединения.
Формулы кислотных оксидов и соответствующих им кислот смотрите в учебнике с.104
Кислоты изменяют цвет индикаторов по другому. Лакмус - красный, метилоранж - розовый, фенолфталеин - бесцветный. Отсюда делаем вывод, что фенолфталеин не подходит для определения кислот, так как он не изменяет своей окраски в кислой среде.
Посмотрим лабораторный опыт:
https://www.youtube.com/watch?v=3j1A1tKxloc
Домашнее задание: параграф 21, письменно: составить уравнения реакций образования азотистой, азотной и угольной кислот.
Урок №9. 22.04.2020
Тема: Количественный состав раствора. Массовая доля растворенного вещества.
Раствор имеет переменный состав, который выражается через концентрацию растворенного вещества. Чтобы определить концентрацию мы будем использовать массовую долю.
Массовая доля растворенного вещества - это отношение массы растворенного вещества к массе раствора.
W=m растворенного вещества / m раствора * 100%
m раствора = m растворенного вещества + m растворителя (воды)
m растворенного вещества = W * m раствора / 100%
m раствора = m растворенного вещества / W * 100%
W выражается в долях единицы или процентах. Например, 0,52 = 52%. Масса - в граммах.
Примеры задач в книге с.100 - 101.
Домашнее задание параграф 20, письменно задачи №1,2 с.102
Урок №10. 23.04.2020
Тема: Решение задач
Просмотреть видеоурок по решению задач на массовую долю:
Домашнее задание: параграф 20 - повторить, письменно: задачи №3,4 с.102.
Урок №7. 15.04.2020
Тема:
Физические свойства воды
Вода может находится в трех агрегатных состояниях.

Лед - при температуре ниже 0 градусов.
Жидкость - при температуре от +1 до +100 градусов.
Пар - от +100 и выше.
Возникает вопрос, почему твердое вещество лед плавает на поверхности воды?
Ответ на этот вопрос в строении молекулы воды. В разных агрегатных состояниях структура изменяется.

Больше узнать о других физических свойствах воды, можно здесь:
 Домашнее задание: параграф 18.
Домашнее задание: параграф 18.
Урок №8. 16.04.2020
Тема: Раствор и его компоненты. Процесс растворения.
Раствор - однородная система переменного состава, которая содержит два или несколько компонентов.
Обязательные компоненты раствора - растворитель (чаще всего вода), растворенное вещество. Растворитель находится в том же агрегатном состоянии, что и раствор. Растворенное вещество может быть в любом агрегатном состоянии.
Во время растворения происходят и физический и химический процессы. Происходит процесс диффузии - перераспределение частиц одного вещества между частицами другого вещества (физический процесс). При растворении происходят и химические превращения веществ, например, выделяется или поглощается тепло.
Растворение - физико-химический процесс, в ходе которого происходит взаимодействие между частицами растворенного вещества и растворителя.
Изменяется и само понятие раствора:
Раствор - однородная система переменного состава, которая содержит растворенное вещество, растворитель и продукты их взаимодействия.
Данный видеоурок поможет вам лучше справиться с домашним заданием
https://www.youtube.com/watch?v=LNFpSgCdj-w
Домашнее задание параграф 19, письменно №3,№4 с.98
Урок №5. 08.04.2020
Обобщение знаний по теме кислород.
Задание 1. Выписать отдельно формулы оксидов и назвать их: N2, Fe2O3, SO2, Zn, HCl, O3, CaO, CO2, H2SO4.
Задание 2. Составить формулы оксидов таких элементов: K, Ba, Al, S (IV), P(V), Cr(VI) и дать названия.
Задание 3 Составьте продукты реакций и уравняйте уравнения реакций:
Al + O2 =
Fe + O2 =
C2H2 + O2 =
Задание 4. Составить уравнения химических реакций , в результате которых из простых веществ образуются такие оксиды: SO2, ZnO, Fe2O3.
Урок №6. 09.04.2020
Вода. Состав молекулы. Распространение в природе.
Вода - самое распространенное в природе сложное вещество.
Качественный состав воды Н2О - гидроген и оксиген входят в состав воды.
Количественный состав воды Н2О - N(H):N(O)= 2:1.
Вода может находиться в трех агрегатных состояниях:
Домашнее задание выучить параграф 17, письменно №2, №3 задания для самоконтроля с.92
Урок №3. 01.04.2020
Химические свойства кислорода
Химические реакции кислорода
Реакции горения Реакции медленного окисления
1. Взаимодействие кислорода с простыми веществами:
а) неметаллами С + О2 = СО2
б) металлами 4К + О2 =2 К2О
2. Взаимодействие кислорода со сложными веществами:
С2Н4 + 3О2 = 2СО2 +2 Н2О
ОСНОВНЫЕ ПОНЯТИЯ ТЕМЫ:
ОКСИДЫ Р2О5, СО2, SO3.
РЕАКЦИЯ СОЕДИНЕНИЯ
3Fe + 2O2 = Fe3O4
УСЛОВИЯ ВОЗНИКНОВЕНИЯ ГОРЕНИЯ
УСЛОВИЯ ПРИКРАЩЕНИЯ ГОРЕНИЯ
Объяснение темы урока вы можете просмотреть в видео
https://www.youtube.com/watch?v=YW-YKCEqIKc
Домашнее задание: выучить параграф 15, письменно: 1) выписать правила; 2) выписать условия возникновения и прекращения горения; 3) составить уравнения реакций и дать названия оксидам:
Na + O2 =
Ba + O2 =
Cl2 + O2 =
N2 + O2=
C3H6 + O2 =
Урок №4. 02.04.2020
Тема: Применение кислорода. Круговорот оксигена в природе.
Кратко о применении кислорода :
Круговорот оксигена в природе можно разобрать, используя схему:
Узнать больше можно, просмотрев презентацию:
https://infourok.ru/prezentaciya-po-himii-primenenie-kisloroda-3127087.html
Домашнее задание : параграф 16, пройти тесты на платформе classtime по ссылке
https://www.classtime.com/sessions/9ENJWP
код сессии 9ENJWP
Урок 1. 18.03.2020р.
Тема:
Воздух. Состав воздуха.
https://interneturok.ru/lesson/chemistry/8-klass/bvewestva-i-ih-prevraweniyab/sostav-vozduha
Задание №1.
Какие простые и сложные вещества содержатся в воздухе? Напишите их формулы и вычислите относительные молекулярные массы.
Задание №2.
Благодаря каким процессам в атмосферу попадают кислород и углекислый газ?
Домашнее задание: посмотреть видео по ссылке, поработать с параграфами 12,13 - выписать ответы.
Ответы отсылать письменные ответы или фото с тетради на почту или в вайбер. Обязательно подписывать свою работу.
Урок 2. 19.03.2020р.
Тема:
Получение кислорода и его физические свойства.
Получение кислорода в лаборатории:
1) разложением калий перманганата при нагревании
2КМnО4 = К2МnО2 + МnО2 + О2
https://www.youtube.com/watch?v=F9VYVbPo08o
2) Разложение гидрогенпероксида в присутствии катализатора манган (IV) оксида МnО2.
https://www.youtube.com/watch?v=xphOEkgGTpo
Задание №1. Описать физические свойства кислорода.
Задание №2. Как добывают кислород в лаборатории?
Задание №3. Как добывают кислород в промышленности?
Задание №4. Что такое катализатор?
Домашнее задание:посмотреть видео по ссылкам, поработать с параграфом 14 - выписать ответы.